Phản ứng hóa học có thể hấp thụ hoặc giải phóng năng lượng dưới dạng nhiệt, ánh sáng hoặc điện. Trong đó, phản ứng tỏa nhiệt đóng vai trò quan trọng trong đời sống và công nghiệp nhờ khả năng sinh năng lượng hiệu quả.
Năng lượng sinh ra từ phản ứng hóa học nào?
Trong thế giới hóa học, phản ứng hóa học luôn đi kèm với sự thay đổi năng lượng. Có những phản ứng cần hấp thụ năng lượng từ môi trường để xảy ra, nhưng cũng có những phản ứng lại "nhả" năng lượng ra ngoài. Câu hỏi đặt ra là, phản ứng hóa học nào giải phóng năng lượng?
Câu trả lời chính là phản ứng tỏa nhiệt. Đây là những phản ứng mà tổng năng lượng của sản phẩm thấp hơn tổng năng lượng của chất phản ứng. Phần năng lượng chênh lệch này sẽ được giải phóng ra môi trường dưới nhiều dạng khác nhau, phổ biến nhất là nhiệt và ánh sáng.
>>> Xem thêm tại: Những loại khí nào gây ra hiện tượng axit mưa?
Phản ứng tỏa nhiệt có đặc điểm gì nổi bật?
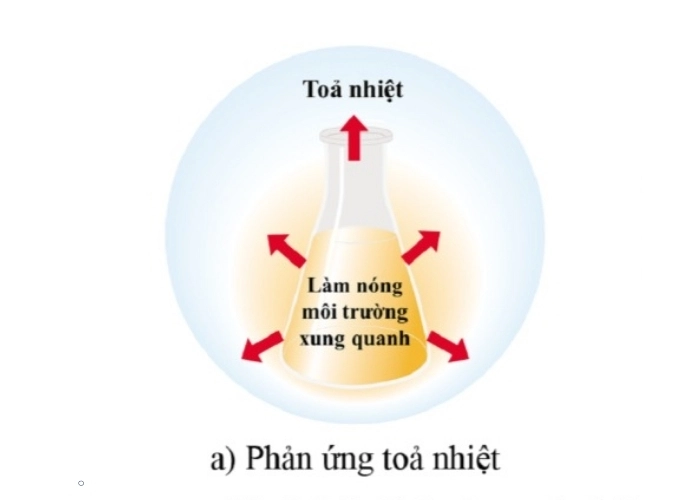
Phản ứng tỏa nhiệt là loại phản ứng hóa học giải phóng năng lượng, thường dưới dạng nhiệt, làm cho môi trường xung quanh nóng lên. Đây là một khái niệm quan trọng trong hóa học năng lượng.
Đặc điểm chính của phản ứng tỏa nhiệt:
+ Năng lượng được giải phóng: Năng lượng hóa học tiềm ẩn trong các liên kết của chất phản ứng được chuyển hóa thành các dạng năng lượng khác (như nhiệt, ánh sáng, hoặc điện) và thoát ra ngoài.
+ Nhiệt độ môi trường tăng: Khi năng lượng giải phóng dưới dạng nhiệt, bạn sẽ cảm thấy môi trường xung quanh phản ứng nóng lên.
+ Biến thiên enthalpy âm (ΔH<0): Trong nhiệt động lực học, phản ứng tỏa nhiệt có biến thiên enthalpy âm, cho thấy hệ đã mất năng lượng.
Các ví dụ phổ biến về phản ứng tỏa nhiệt:
Phản ứng đốt cháy:
+ Đây là ví dụ điển hình và dễ thấy nhất. Khi bạn đốt củi, than, gas hay xăng, chúng phản ứng với oxy trong không khí để tạo ra nhiệt và ánh sáng.
+ Ví dụ: Đốt cháy khí metan (CH₄) trong bếp ga: CH4+2O2→CO2+2H2O+năng lượng (nhiệt + ánh sáng)
Phản ứng trung hòa acid-base:
+ Khi acid và base phản ứng với nhau, chúng cũng giải phóng nhiệt.
+ Ví dụ: Trộn dung dịch NaOH và HCl: NaOH+HCl→NaCl+H2O+nhiệt
Phản ứng nổ:
+ Các vụ nổ là ví dụ cực đoan của phản ứng tỏa nhiệt, giải phóng năng lượng rất nhanh và mạnh.
+ Ví dụ: Thuốc nổ TNT giải phóng lượng lớn năng lượng trong thời gian ngắn.
Sự hô hấp của sinh vật:
+ Trong cơ thể chúng ta, glucose phản ứng với oxy để tạo ra năng lượng duy trì sự sống. Đây cũng là một phản ứng tỏa nhiệt có kiểm soát.
+ C6H12O6+6O2→6CO2+6H2O+năng lượng (ATP + nhiệt)
Hóa học năng lượng và tầm quan trọng trong đời sống
Việc nghiên cứu hóa học năng lượng và đặc biệt là các phản ứng tỏa nhiệt có ý nghĩa vô cùng to lớn trong đời sống và công nghệ hiện đại.
Hóa học năng lượng và vai trò thực tiễn: Hóa học năng lượng, đặc biệt là các phản ứng sinh nhiệt, có vai trò thiết yếu trong đời sống và sản xuất.

>>> Xem thêm tại: Nguyên tố nào có số hiệu nguyên tử là 1? Giải mã Hydro
Sản xuất năng lượng: Phản ứng sinh nhiệt được ứng dụng trong nhà máy nhiệt điện và động cơ ô tô, nơi quá trình đốt nhiên liệu tạo ra điện hoặc chuyển hóa thành động năng.
Công nghiệp: Nhiều quy trình sản xuất cần nhiệt lượng lớn, như nung đá vôi, đều dựa vào phản ứng sinh nhiệt.
Sưởi ấm: Việc đốt nhiên liệu để làm ấm không gian sống là một ví dụ đơn giản về ứng dụng của phản ứng sinh nhiệt.
Phòng cháy chữa cháy: Hiểu rõ phản ứng sinh nhiệt giúp kiểm soát nguy cơ cháy nổ và thiết kế hệ thống an toàn hiệu quả.
Phản ứng hóa học giải phóng năng lượng không chỉ có trong phòng thí nghiệm mà còn hiện diện ở mọi nơi: từ cơ thể sống đến động cơ đốt trong, mang lại tiện ích to lớn cho con người.



